Apresentada em 1887 pelo químico sueco Svante Arrhenius, como parte de sua teoria da dissociação eletrolítica (é a dissolução de uma substância em água gerando partículas menores chamadas de íons). Segundo essa teoria:
![]() Base- é toda substância que produz OH–. A neutralização seria a reação entre essas duas espécies iônicas, produzindo água:
Base- é toda substância que produz OH–. A neutralização seria a reação entre essas duas espécies iônicas, produzindo água:![]() SAL é toda substância resultante da reação entre um ácido e uma base, também denominada de reação de neutralização, que apresenta como produto água.
SAL é toda substância resultante da reação entre um ácido e uma base, também denominada de reação de neutralização, que apresenta como produto água.![]()
Teoria dos Sistemas Solventes
Esta teoria começou a ser desenvolvida em 1905 por E. C. Franklin, principalmente para a NH3 líquida (amônia), e depois por vários outros pesquisadores, por generalização da teoria de Arrhenius. Pode-se dizer que é uma obra coletiva. Considera que todo solvente sofre uma auto-ionização, gerando um cátion (ácido) e uma base (ânion): solvente -> cátion + ânion
Ácido- é tudo que faz aumentar a concentração do cátion característico do solvente
Base- é o que aumenta a concentração do ânion característico.
Sal- é o resultado da reação de neutralização, ou seja, é a formação do solvente a partir destes cátions e ânions característicos.
2 H2O -> H3O+ + OH-
2 NH3 -> NH4+ + NH2-
2 SO2 -> SO2+ + SO32-
2 POCl3 -> POCl2+ + POCl4-
Dezenas de solventes foram estudados, principalmente visando obter novas reações e novos compostos.
Teoria dos Pares Conjugados de Brönsted-Lowry
A real ciência está em constante evolução, o que é uma verdade absoluta hoje, pode não ser amanhã. Novas observações, novas constatações e novos experimentos permitem a evolução de teorias e conceitos.
Os conceitos formulados por Arrhenius não conseguiam justificar o comportamento de determinadas reações em soluções não aquosas. Surgiram então novos conceitos, baseados nas estruturas moleculares e eletrônicas das substâncias.
Observando que todos os ácidos de Arrhenius continham hidrogênios ionizáveis, J. N. Brönsted e T. M. Lowry propuseram, independentemente que:
Ácido - é toda espécie química capaz de ceder prótons. Próton é o nome que se dá as espécies H+ e H3O+, também chamados de hidrogênios ácidos
![]() Base - é toda espécie química capaz de receber prótons.
Base - é toda espécie química capaz de receber prótons.![]()
Observando o comportamento da água acima, concluímos que ela possui um duplo comportamento. A água quando se liga com um ácido (HCl), ela possui um carater básico, e quando se liga com uma base (NH3), admite um comportamento ácido. Assi, não se pode afirmar que uma substância é ácido ou base, irá depender de com quem ela está se ligando.
Brönsted e Lowry formularam a seguinte teoria:
Ácidos- são substâncias que transferem prótons, veja por este lado: H2O = H—OH, o hidrogênio está ligado a hidroxila por uma ligação covalente, se quebrarmos esta ligação, obteremos:
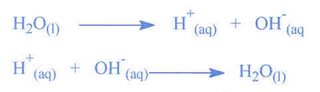 Como a reação é a mesma, não importando de que lado o reagente está chamamos de reação de reversível, e a simbologia para representar esta reação é uma dupla seta com sentidos opostos
Como a reação é a mesma, não importando de que lado o reagente está chamamos de reação de reversível, e a simbologia para representar esta reação é uma dupla seta com sentidos opostos![]() Bases- são substâncias que recebem prótons.
Bases- são substâncias que recebem prótons.
Sal-é a substância resultante da reação de neutralização, que seria uma transferência de prótons entre um ácido e uma base.
AH + B -> BH + A
HCl + NH3 -> NH4+ + Cl-
HAc + H2O -> H3O+ + Ac-
H3O+ + OH- -> 2 H2O
De acordo com esse conceito, a água (e muitas outras substâncias) poderá apresentar um comportamento ácido ou base, dependendo do outro reagente e que possuem um par conjugado. Um ácido possui uma base conjugada, e uma base possui um ácido conjugado, formando desta maneira o que os cientistas denominaram de pares conjugados. Lembremos ainda que não é necessária a presença de água para que uma substância seja ácido ou base.
HCl + H2O -> H3O+ + Cl- a água está recebendo um próton (H+), é uma base
NH3 + H2O -> NH4+ + OH- a água está doando um próton, é um ácido
Ácidos e bases conjugados
De acordo com esta observação, Brönsted e Lowry concluíram que a todo ácido corresponderia a uma base conjugada, e a toda base um ácido conjugado, oa quais designou de pares conjugados.
Teoria Eletrônica de Lewis
A teoria de Bronsted e Lowry limitava o conceito a substâncias capazes de dar ou aceitar prótons, e não conseguia ainda explicar o comportamento ácido-base de muitas espécies que, não contendo prótões na sua composição, ainda assim apresentam comportamento ácido.
Em 1923 Gilbert Newton Lewis mantendo a teoria ácido-base de Bronsted-Lowry apresentou uma nova ampliação dos conceitos, baseando-se em estruturas eletrônicas.
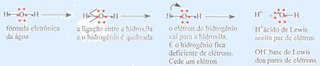
Ácido é toda e qualquer molécula química que aceita pares de elétrons
Base é toda e qualquer molécula química que doa de pares de elétrons
O conceito é aplicável para moléculas que possuam um par de elétrons disponível (caso de uma base) ou uma orbital vazio capaz de aceitar um par de elétrons (caso de um ácido) e estende o conceito de ácido e base para além das espécies capazes de dar ou receber prótons. Resumidamente:
Resumidamente: Exemplos de reações de neutralização:
Exemplos de reações de neutralização:
H+(aq) + OH-(aq) = H2O(l)
BF3 + KF = K+ + [BF4]-
PtCl4 + 2 KCl = 2 K+ + [PtCl6]2-
SO3 + K2O = 2 K+ + [SO4]2-
SiO2 + K2O = 2K+ + SiO42-
HCl + NH3 = [NH4]+ + Cl-
HAc + H2O = H3O+ + Ac-
SO2+ + SO32- = 2 SO2
CO2 + CaO = Ca2+ + CO32-
BF3 + :NH3 = H3N:BF3 considerada uma reação ácido-base, não englobada pela teorias anteriores. O produto formado pode ser também representado por H3N-> BF3 (a seta, muitas vezes utilizada, indica o sentido da doação do par eletrônico).
Pesquise mais sobre o assunto:
http://sbqensino.foco.fae.ufmg.br/uploads/540/historia.pdf#search=%22Teoria%20%C3%A1cido%20base%22
http://www.enaol.com/disciplinas/quimica/teoria_acidobase.htm
http://www.scielo.br/scielo.php?script=sci_arttext&pid=S0100-40422000000100023
www.unificado.com.br/quimica/prof_busato/funcoes_inorganicas.ppt
http://www.profcupido.hpg.ig.com.br/aulas_quimica_inorganica.htm
http://www.inf.ufes.br/~neyval/Monitoramento_Qualidade_Ar/Revisao_de_quimica.pdf#search=%22fun%C3%A7%C3%B5es%20inorg%C3%A2nicas%22
http://www.sistemapoliedro.com.br/new/interna.aspx?Face=material_aula.htm
http://sbqensino.foco.fae.ufmg.br/uploads/333/conceito.pdf
Se você quer aprender a fazer alguns experimentos sobre ácidos e bases, click no site a baixo e vá para ácidos e bases:
http://www.cdcc.sc.usp.br/quimica/experimentos/ensinofund.html
http://educar.sc.usp.br/quimapoio/repolho.html
http://educar.sc.usp.br/youcan/acid/acid.html
http://www.feiradeciencias.com.br/sala21/21_07.asp
Faixa de pH do repolho roxo
http://www.sbq.org.br/ranteriores/23/resumos/0256/index.html
http://sbqensino.foco.fae.ufmg.br/uploads/321/exper1.pdf
Nos sites a baixo você conhecerá algumas aplicações:
http://www.rossetti.eti.br/principais-compostos-inorganicos.asp
http://pt.wikibooks.org/wiki/Aplica%C3%A7%C3%B5es_de_%C3%A1cidos,_bases,_sais_e_%C3%B3xidos
http://br.geocities.com/chemicalnet/bases.htm
Chuva Ácida
http://www.cdcc.sc.usp.br/quimica/ciencia/chuva.html
http://br.geocities.com/acideznachuva134/1.html









