Apresentada em 1887 pelo químico sueco Svante Arrhenius, como parte de sua teoria da dissociação eletrolítica (é a dissolução de uma substância em água gerando partículas menores chamadas de íons). Segundo essa teoria:
![]() Base- é toda substância que produz OH–. A neutralização seria a reação entre essas duas espécies iônicas, produzindo água:
Base- é toda substância que produz OH–. A neutralização seria a reação entre essas duas espécies iônicas, produzindo água:![]() SAL é toda substância resultante da reação entre um ácido e uma base, também denominada de reação de neutralização, que apresenta como produto água.
SAL é toda substância resultante da reação entre um ácido e uma base, também denominada de reação de neutralização, que apresenta como produto água.![]()
Teoria dos Sistemas Solventes
Esta teoria começou a ser desenvolvida em 1905 por E. C. Franklin, principalmente para a NH3 líquida (amônia), e depois por vários outros pesquisadores, por generalização da teoria de Arrhenius. Pode-se dizer que é uma obra coletiva. Considera que todo solvente sofre uma auto-ionização, gerando um cátion (ácido) e uma base (ânion): solvente -> cátion + ânion
Ácido- é tudo que faz aumentar a concentração do cátion característico do solvente
Base- é o que aumenta a concentração do ânion característico.
Sal- é o resultado da reação de neutralização, ou seja, é a formação do solvente a partir destes cátions e ânions característicos.
2 H2O -> H3O+ + OH-
2 NH3 -> NH4+ + NH2-
2 SO2 -> SO2+ + SO32-
2 POCl3 -> POCl2+ + POCl4-
Dezenas de solventes foram estudados, principalmente visando obter novas reações e novos compostos.
Teoria dos Pares Conjugados de Brönsted-Lowry
A real ciência está em constante evolução, o que é uma verdade absoluta hoje, pode não ser amanhã. Novas observações, novas constatações e novos experimentos permitem a evolução de teorias e conceitos.
Os conceitos formulados por Arrhenius não conseguiam justificar o comportamento de determinadas reações em soluções não aquosas. Surgiram então novos conceitos, baseados nas estruturas moleculares e eletrônicas das substâncias.
Observando que todos os ácidos de Arrhenius continham hidrogênios ionizáveis, J. N. Brönsted e T. M. Lowry propuseram, independentemente que:
Ácido - é toda espécie química capaz de ceder prótons. Próton é o nome que se dá as espécies H+ e H3O+, também chamados de hidrogênios ácidos
![]() Base - é toda espécie química capaz de receber prótons.
Base - é toda espécie química capaz de receber prótons.![]()
Observando o comportamento da água acima, concluímos que ela possui um duplo comportamento. A água quando se liga com um ácido (HCl), ela possui um carater básico, e quando se liga com uma base (NH3), admite um comportamento ácido. Assi, não se pode afirmar que uma substância é ácido ou base, irá depender de com quem ela está se ligando.
Brönsted e Lowry formularam a seguinte teoria:
Ácidos- são substâncias que transferem prótons, veja por este lado: H2O = H—OH, o hidrogênio está ligado a hidroxila por uma ligação covalente, se quebrarmos esta ligação, obteremos:
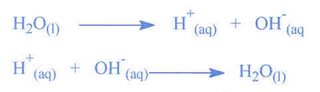 Como a reação é a mesma, não importando de que lado o reagente está chamamos de reação de reversível, e a simbologia para representar esta reação é uma dupla seta com sentidos opostos
Como a reação é a mesma, não importando de que lado o reagente está chamamos de reação de reversível, e a simbologia para representar esta reação é uma dupla seta com sentidos opostos![]() Bases- são substâncias que recebem prótons.
Bases- são substâncias que recebem prótons.
Sal-é a substância resultante da reação de neutralização, que seria uma transferência de prótons entre um ácido e uma base.
AH + B -> BH + A
HCl + NH3 -> NH4+ + Cl-
HAc + H2O -> H3O+ + Ac-
H3O+ + OH- -> 2 H2O
De acordo com esse conceito, a água (e muitas outras substâncias) poderá apresentar um comportamento ácido ou base, dependendo do outro reagente e que possuem um par conjugado. Um ácido possui uma base conjugada, e uma base possui um ácido conjugado, formando desta maneira o que os cientistas denominaram de pares conjugados. Lembremos ainda que não é necessária a presença de água para que uma substância seja ácido ou base.
HCl + H2O -> H3O+ + Cl- a água está recebendo um próton (H+), é uma base
NH3 + H2O -> NH4+ + OH- a água está doando um próton, é um ácido
Ácidos e bases conjugados
De acordo com esta observação, Brönsted e Lowry concluíram que a todo ácido corresponderia a uma base conjugada, e a toda base um ácido conjugado, oa quais designou de pares conjugados.
Teoria Eletrônica de Lewis
A teoria de Bronsted e Lowry limitava o conceito a substâncias capazes de dar ou aceitar prótons, e não conseguia ainda explicar o comportamento ácido-base de muitas espécies que, não contendo prótões na sua composição, ainda assim apresentam comportamento ácido.
Em 1923 Gilbert Newton Lewis mantendo a teoria ácido-base de Bronsted-Lowry apresentou uma nova ampliação dos conceitos, baseando-se em estruturas eletrônicas.
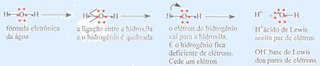
Ácido é toda e qualquer molécula química que aceita pares de elétrons
Base é toda e qualquer molécula química que doa de pares de elétrons
O conceito é aplicável para moléculas que possuam um par de elétrons disponível (caso de uma base) ou uma orbital vazio capaz de aceitar um par de elétrons (caso de um ácido) e estende o conceito de ácido e base para além das espécies capazes de dar ou receber prótons. Resumidamente:
Resumidamente: Exemplos de reações de neutralização:
Exemplos de reações de neutralização:
H+(aq) + OH-(aq) = H2O(l)
BF3 + KF = K+ + [BF4]-
PtCl4 + 2 KCl = 2 K+ + [PtCl6]2-
SO3 + K2O = 2 K+ + [SO4]2-
SiO2 + K2O = 2K+ + SiO42-
HCl + NH3 = [NH4]+ + Cl-
HAc + H2O = H3O+ + Ac-
SO2+ + SO32- = 2 SO2
CO2 + CaO = Ca2+ + CO32-
BF3 + :NH3 = H3N:BF3 considerada uma reação ácido-base, não englobada pela teorias anteriores. O produto formado pode ser também representado por H3N-> BF3 (a seta, muitas vezes utilizada, indica o sentido da doação do par eletrônico).
Pesquise mais sobre o assunto:
http://sbqensino.foco.fae.ufmg.br/uploads/540/historia.pdf#search=%22Teoria%20%C3%A1cido%20base%22
http://www.enaol.com/disciplinas/quimica/teoria_acidobase.htm
http://www.scielo.br/scielo.php?script=sci_arttext&pid=S0100-40422000000100023
www.unificado.com.br/quimica/prof_busato/funcoes_inorganicas.ppt
http://www.profcupido.hpg.ig.com.br/aulas_quimica_inorganica.htm
http://www.inf.ufes.br/~neyval/Monitoramento_Qualidade_Ar/Revisao_de_quimica.pdf#search=%22fun%C3%A7%C3%B5es%20inorg%C3%A2nicas%22
http://www.sistemapoliedro.com.br/new/interna.aspx?Face=material_aula.htm
http://sbqensino.foco.fae.ufmg.br/uploads/333/conceito.pdf
Se você quer aprender a fazer alguns experimentos sobre ácidos e bases, click no site a baixo e vá para ácidos e bases:
http://www.cdcc.sc.usp.br/quimica/experimentos/ensinofund.html
http://educar.sc.usp.br/quimapoio/repolho.html
http://educar.sc.usp.br/youcan/acid/acid.html
http://www.feiradeciencias.com.br/sala21/21_07.asp
Faixa de pH do repolho roxo
http://www.sbq.org.br/ranteriores/23/resumos/0256/index.html
http://sbqensino.foco.fae.ufmg.br/uploads/321/exper1.pdf
Nos sites a baixo você conhecerá algumas aplicações:
http://www.rossetti.eti.br/principais-compostos-inorganicos.asp
http://pt.wikibooks.org/wiki/Aplica%C3%A7%C3%B5es_de_%C3%A1cidos,_bases,_sais_e_%C3%B3xidos
http://br.geocities.com/chemicalnet/bases.htm
Chuva Ácida
http://www.cdcc.sc.usp.br/quimica/ciencia/chuva.html
http://br.geocities.com/acideznachuva134/1.html

2 comentários:
Olá!!!! Quero dar os PARABENS pelo blog!!! me ajudou muito a entender a matéria da escola!!!!! Obrigada de verdade!!!Beijos!!
Wow, nice post,there are many person searching about that now they will find enough resources by your post.Thank you for sharing to us.Please one more post about that..
Postar um comentário